Реферат: Открытие электрона. Открытие электрона: Джозеф Джон Томсон Термин электрон в научный оборот ввел
1.1 Открытие электрона и радиоактивности.
Рождение представлений о сложном строении атома
Дискретность электрического тока отражена в работах Фарадея по электролизу - один и тот же ток приводит к выделению на электродах разного количества вещества в зависимости от того, какое вещество растворено. При выделении одного моля одновалентного вещества через электролит проходит заряд в 96 500 Кл, а при двухвалентном - заряд удваивается. После определения в конце XIX в. числа Авогадро появилась возможность оценить величину элементарного электрического заряда. Так как 6,02 10 23 атомов переносят заряд в 96 500 Кл, то на долю одного приходится 1,2-10 -19 Кл. Стало быть, это - мельчайшая порция электричества или «атома электричества». Георг Стоней предложил и назвать этот «атом электричества» электроном.
Работа с токами в газах осложнена трудностями получения разреженной газовой среды. Немецкий механик-стеклодув Г. Гейслер изготовлял для развлечений трубки с разреженным газом, светящимся при пропускании через него электрического тока. В них В. Гиттгофф обнаружил вызывающее флуоресценцию стенок трубки излучение из катода, которое назвали катодными лучами. Как установил английский физик У. Крукс, эти лучи распространялись по прямой, отклонялись магнитным полем и оказывали механическое воздействие.
Французский физик Ж. Перрен поместил внутри трубки перед катодом металлический цилиндр с отверстием против катода и обнаружил, что цилиндр заряжается отрицательно. Когда лучи отклонялись магнитным полем и не попадали в цилиндр, он оказывался незаряженным. Через два года Дж.Томсон поместил цилиндр не перед катодом, а сбоку: поднесенный магнит искривлял катодные лучи так, что они попадали в цилиндр и заряжали его отрицательно, но флуоресцирующее пятно на стекле смещалось. Значит, лучи - отрицательно заряженные частицы. Такой измерительный прибор называют электронно-лучевой трубкой высокого вакуума. Под действием силы Лоренца, вызванной магнитным полем, включенным в области конденсатора, светящийся след падения пучка на экране смещается. Так в 1895 г. родилась новая наука - электроника.
Действуя одновременно электрическим и магнитным полями и меняя их величину, Томсон подобрал их так, чтобы они компенсировались, катодные лучи не отклонялись, и пятно на стекле не смещалось. Он получил отношение электрического заряда к массе частицы е/т = 1,3 10 -7 Кл/г. Независимо от Томсона это значение измерил для катодных лучей В. Кауфман и получил близкое значение. Томсон назвал эту частицу корпускулой, а электроном - только ее заряд, но потом и саму частицу катодных лучей назвали электроном (от греч. elektron - янтарь).
Открытие электрона, изучение его уникальных свойств стимулировали исследования строения атома. Стали понятны процессы поглощения и испускания энергии веществом; сходства и отличия химических элементов, их химическая активность и инертность; внутренний смысл Периодической системы химических элементов Д. И. Менделеева, природа химической связи и механизмы химических реакций; появились совершенно новые приборы, в которых движение электронов играет определяющую роль. Изменялись взгляды на природу материи. С открытия электрона (1897) начался век атомной физики.
Из многочисленных опытов с пропусканием электронов через вещество Дж.Томсон заключил, что число электронов в атоме связано с величиной атомной массы. Но в нормальном состоянии атом должен быть электрически нейтрален, и поэтому в каждом атоме количества зарядов разных знаков равны. Поскольку масса электрона составляет примерно 1/2000 массы атома водорода, то масса положительного заряда должна быть в 2000 раз больше массы электрона. Например, у водорода почти вся масса связана с положительным зарядом. С открытием электрона сразу же появились новые проблемы. Атом нейтрален, значит, в нем должны быть другие частицы с положительным зарядом. Они еще не были открыты.
Французский физик А. Беккерель, исследуя люминесценцию, открыл (1896) явление радиоактивности. Его интересовала связь флуоресценции от катодных лучей на стенках трубки и рентгеновские лучи, испускаемые от этой части трубки. Облучая различные вещества, он пытался выяснить, могут ли рентгеновские лучи испускаться фосфоресцирующими телами, облученными солнечным светом. Вскоре им занялись супруги Кюри и открыли более активный элемент, который назвали полонием в честь Польши - родины Марии Кюри. Измеряя величину эффекта, Склодовская-Кюри открыла новый элемент - радий, а сам эффект излучения назвала радиоактивностью (от лат. radio - испускаю лучи). Интенсивность излучения радия в сотни тысяч раз больше, чем у урана. Затем был открыт третий радиоактивный элемент - актиний. И произошел некий «бум» в изучении радиоактивности.
К концу 1899 г. сотрудник Дж.Томсона Э. Резерфорд заключил: «...опыты показывают, что излучение урана является сложным и состоит по крайней мере из двух различных видов: одно, быстро поглощаемое, назовем его а-излучением; другое, более проникающее, назовем его -излучением». Через три года П. Вийяр нашел еще одну компоненту излучения, которая не отклонялась магнитным полем, ее назвали -лучами. Радиоактивность быстро находила применение в естествознании и медицине.
Атом переставал считаться неделимым. Идея о строении всех атомов из атомов водорода была высказана еще в 1815 г. английским врачом У. Праутом. Сомнения о неделимости атомов породили открытие спектрального анализа и Периодической системы химических элементов. Получалось, что сам атом - это сложная структура с внутренними движениями составных частей, ответственных за характерные спектры. Стали появляться и модели его строения.
Модель атома - положительный заряд распределен в положительно заряженной достаточно большой области (возможно, сферической формы), а электроны вкраплены в него, как «изюм в пудинг» - в 1902 г. предложил Кельвин. Дж.Томсон развил его идею: атом - капля пудинга положительно заряженной материи, внутри которой распределены электроны, находящиеся в состоянии колебательного процесса. Из-за этих колебаний атомы и излучают электромагнитную энергию; так он смог объяснить дисперсию света, но возникло и много вопросов. Для объяснения Периодической системы химических элементов он исследовал разные конфигурации электронов, предполагая, что устойчивым конфигурациям соответствует устройство неактивных элементов типа благородных газов, а неустойчивым - более активных. По длинам волн испускаемого атомами света Томсон оценил область, занимаемую таким атомом, - около 10 -10 м. Он делал очень много предположений, увлекшись расчетом характеристик излучения по теории Максвелла, так как считал, что внутри атома действуют только электромагнитные силы. В 1903 г. Томсон получил, что электроны при движении должны излучать эллиптические волны, в 1904 г. - что при числе электронов более 8 они должны располагаться кольцами и число их в каждом кольце уменьшаться с уменьшением радиуса кольца. Число электронов не позволяет быть устойчивыми радиоактивным атомам, они выбрасывают а-частицы, и устанавливается новая структура атома. Эксперимент Э. Ре-зерфорда, одного из учеников Томсона, привел к ядерной модели строения атома.
Открытия конца XIX в. - рентгеновских лучей (1895), естественной радиоактивности (Беккерель, 1896), электрона (Дж.Томсон, 1897), радия (Пьер и Мария Кюри, 1898), квантового характера излучения (Планк, 1900) были началом революции в науке.
1.2 Планетарная модель строения атома. Современная наука и постулаты Бора
Планетарную модель строения атома первым предложил Ж. Перрен, пытаясь объяснить наблюдаемые свойства орбитальным движением электронов. Но В. Вин посчитал ее несостоятельной. Во-первых, электрон при вращении согласно классической электродинамике должен непрерывно излучать энергию и, в конце концов, упасть на ядро. Во-вторых, из-за непрерывной потери энергии излучение атома должно иметь непрерывный спектр, а наблюдается линейчатый спектр.
Опыты по прохождению а-частиц через тонкие пластинки из золота и других металлов провели сотрудники Э.Резерфорда Э.Марсден и Х.Гейгер (1908). Они обнаружили, что почти все частицы проходят через пластинку свободно, и только 1/10 000 из них испытывает сильное отклонение - до 150°. Модель Томсона это не могла объяснить, но Резерфорд, его бывший ассистент, сделал оценки доли отклонений и пришел к планетарной модели: положительный заряд сосредоточен в объеме порядка 10 - 15 со значительной массой.
Считая орбиты электронов в атоме закрепленными, Томсон в 1913 г. тоже пришел к планетарной модели строения атома. Но, решая задачу на устойчивость такого атома с использованием закона Кулона, он нашел устойчивую орбиту лишь для одного электрона. Ни Томсон, ни Резерфорд не могли объяснить испускание а-частиц при радиоактивном распаде - выходило, что в центре атома должны быть и электроны?! Его ассистент Г. Мозли измерил частоту спектральных линий ряда атомов Периодической системы и установил, что «атому присуща некая характерная величина, которая регулярно увеличивается при переходе от атома к атому. Это количество не может быть ни чем иным, как только зарядом внутреннего ядра».
Построение теории строения атома на основе планетарной модели наталкивалось на обилие противоречий.
Сначала датский физик Н. Бор пытался применить классическую механику и электродинамику к задаче о торможении заряженных частиц при движении через вещество, но при заданном значении энергии электрона появлялась возможность приписывать ему произвольные параметры орбиты (или частоты), что приводило к парадоксам.
Теорию строения атома Бор согласовал с проблемой происхождения спектров. Он дополнил модель Резерфорда постулатами, обеспечивающими устойчивость атома и линейчатый спектр его излучения. Бор отказался от представлений классической механики и обратился к квантовой гипотезе Планка: определенное соотношение между кинетической энергией в кольце и периодом обращения - это перенесение соотношения Е= hv , выражающего связь между энергией и частотой осциллятора, для системы, совершающей периодическое движение. Спектральные формулы Бальмера, Ридберга и Ритца позволили сформулировать требования обеспечения устойчивости атома и линейчатого характера спектра атома водорода: в атоме существует несколько стационарных состояний (или орбит электронов в планетарной модели), на которых атом не излучает энергии; при переходе электрона с одной стационарной орбиты на другую атом излучает или поглощает порцию энергии, пропорциональную частоте, согласующейся с правилом частот Ридберга- Ритца.
Итак, Бор постулировал частоты и существование стационарных состояний. То, что электрон может находиться только на определенных орбитах, сразу объясняло линейчатый спектр атомов - электрон испускает свет только при переходе с одной орбиты на другую, т.е. дискретными порциями, и не излучает, находясь на дозволенной орбите. Правильность предположений Бора могло подтвердить только хорошее согласие с экспериментом.
Применив свою теорию к строению атома водорода, Бор объяснил две (известные тогда) спектральные серии и предсказал еще две, пока не открытые. Он дал рациональное объяснение сериям спектральных линий, определил радиус атома и подсчитал значение постоянной Ридберга, входившей в комбинационный принцип Ридберга - Ритца. Это было огромным успехом. Но при переходе к более сложным атомам Бор столкнулся с трудностями: для атома гелия - только математическими, а при нескольких электронах задача оказалась сложнее, чем задача многих тел в теории Ньютона. И Бор стал строить водородоподобные модели. Теорию усовершенствовал немецкий физик А. Зоммерфельд. Из его расчетов получалось, что орбита - прецессирующий эллипс. Но такое искусственное соединение классических и квантовых представлений вело к неточным результатам для сложных атомов, не объясняло разную интенсивность линий в спектрах и т.д., хотя данные по спектрам водорода уже в 1914 г. были подтверждены.

Модель Резерфорда-Бора - первая квантовая модель строения атома. Объединив в себе результаты, полученные при исследованиях радиоактивности, оптических и электромагнитных явлений, она положила начало новой эпохе в развитии теории атома и сразу же обнаружила свою плодотворность в спектроскопии и теории химической связи. Предсказание спектра атома водорода - выдающееся достижение теории и величайший триумф физики. Впоследствии установили, что электрон не может рассматриваться как материальная точка, он обладает волновыми свойствами, имеет структуру, зависящую от его состояния, а стационарных орбит не существует. Из-за волновой природы электроны и их заряды как бы размазаны по пространству атома, причем так, что электронная плотность неоднородна и имеет максимумы в определенных местах. Описание поведения электронного облака, данное в квантовой механике, становилось все более далеким от наглядности. Специфика квантово-полевых представлений заключается в вероятностной форме законов.
При очень больших значениях энергии, сообщенной атомам, они теряют свои свойства, образуя четвертое агрегатное состояние - плазму. В плазме исчезают почти все упорядочения, отличающие один атом от другого, там царит хаос. Плазма газообразного неона (на атом - 10 электронов) имеет те же свойства, что и плазма газообразного натрия с 11 электронами. Хаос таких высоких температур наблюдаем только в лаборатории, а для космоса - обычное явление. Бор показал, что для больших длин волн к формуле Бальмера можно прийти по классической электродинамике (в этой области спектра справедлива формула Рэлея-Джинса). Это положение, названное «принципом соответствия», стало методологическим основанием первоначального развития квантовой механики. В пределе, когда стационарные состояния оказываются близкими и мало отличимыми, можно пользоваться классическими представлениями. Но для развития теории этот принцип не оказал конструктивной помощи. Ван-дер-Варден назвал весь период с 1919 по 1925 г. периодом «систематического угадывания» на основе принципа соответствия. С.И.Вавилов считал, что неудача с расчетами атома гелия лишила Бора мощного орудия исследования - использования классических представлений для «почти интуитивного угадывания истинных отношений».
2.1 Строение химических элементов и понимание Периодической таблицы Менделеева
В своей Нобелевской речи Бор отметил, что его теория объясняет молекулярные спектры, неплохо согласуясь с опытом. При переходе к объяснению строения химических элементов он предположил, что замкнутые конфигурации энергетически более выгодны и после заполнения одной оболочки начинают заполняться следующие. После создания Бором квантовой теории атома водорода и успехов квантовых представлений в других областях науки активно развивалась спектроскопия, которая явилась ключом в мир внутриатомных явлений.
Еще в 1896 г. П.Зееман осуществил опыт, который не успел провести Фарадей. Пламя горелки он поместил между полюсами электромагнита и наблюдал спектр. При наблюдении поперек поля кроме основной линии с частотой колебаний, которая была бы без поля, были две линии, смещенные в разные стороны от основной. Все три линии линейно поляризованы. При наблюдении вдоль поля несмещенной компоненты нет, а смещенные - поляризованы по кругу в противоположных направлениях. Х.Лоренц объяснил эффект Зеемана вращением электронов по круговой орбите с циклической частотой, определяемой силой Лоренца. Дж.Лармор учел прецессию электронов вокруг силовых линий магнитного поля с этой частотой. Теория Лармора-Лоренца - выдающееся достижение электронной теории, и ее авторы были удостоены Нобелевской премии за открытие и объяснение эффекта Зеемана (1902). Но квантовая теория, развиваемая А. Зоммерфельдом, не могла ничего сказать о поляризации и интенсивности линий, их определили в нормальном эффекте Зеемана с помощью принципа соответствия Бора. На практике чаще наблюдается расчленение на несколько компонентов (линий). Как указывал в 1919 г. Д.С.Рождественский, эта проблема тесно связана с магнитными свойствами атома.
Но не был интерпретирован аномальный эффект Зеемана, когда возникало отличное от триплета расщепление линии в магнитном поле. Паули, работая у Бора два года над этой проблемой, выдвинул гипотезу ядерного спина для объяснения сверхтонкой структуры спектральных линий. Он считал, что необъясненные явления «возникают вследствие двузначности свойств электрона, которую нельзя описать классически» (1924). Фактически это и была гипотеза существования спина электрона, которую робко высказывал еще Комптон (1921).
Идея опыта состояла в использовании известного факта притяжения большим магнитом маленьких, у которых на северный и южный полюсы действуют разные силы из-за неоднородности большого магнита. В однородном поле они просто повернулись бы в направлении поля. По классической теории на экране пучок должен дать размытое изображение - магнитный момент атома может принимать любые значения. По квантовой теории следовало ожидать, что пучок или не расщепится (как должно быть у водорода), или расщепится не менее чем на три пучка (при наличии магнитного момента). Но получалось, что пучок атомов водорода, серебра, натрия, калия и других одновалентных атомов расщепляется на два пучка. Поэтому и возникла гипотеза о собственном механическом и магнитном моменте электрона.
С позиции классической теории наличие таких моментов может быть обусловлено вращением электрона вокруг собственной оси. Тогда он как вращающаяся масса будет обладать моментом импульса. А вращающийся заряд есть совокупность круговых токов, т.е. появляется и магнитный момент.
Спин электрона имеет размерность вращательного момента-импульса, умноженного на расстояние. Говорят, что его состояния - «вверх» и «вниз». В магнитном поле он направлен по полю или против него. В том же 1924 г. Паули сформулировал принцип: на одной орбите не могут одновременно находиться более двух тождественных частиц с полуцелыми спинами. Спин электрона описывает асимметрию электрона, неизотропность его свойств.
Запрет Паули привел к новым открытиям, к пониманию тепло- и электропроводности металлов и полупроводников. К 1927 г. Паули сумел объяснить парамагнетизм электронного газа в металле и структуру электронных оболочек в атоме.
Электронные оболочки атомов строились с помощью принципа Паули. Так была понята Периодическая система химических элементов Д. И. Менделеева. Каждый слой представлялся совокупностью стационарных орбит. По Бору, электроны только после заполнения оболочки начинают занимать более высокие орбиты. Методы нахождения допустимых орбит определялись правилами квантования Бора - Зоммерфельда, позволившими продвинуть модель Бора от водорода к другим атомам. Оказалось, что электроны движутся не по окружностям, а по эллипсам, значит, находящиеся на одном эллипсе электроны должны отличаться ориентацией, а эллипсы одного слоя - эксцентриситетом.
Значения энергии, которые может принимать движущаяся частица, определяются главным квантовым числом (и): п = 1, 2, 3,... Электронные слои обозначают большими буквами латинского алфавита К, L , М, N , О и т.д. Наибольшее количество электронов в слое равно 2n 2 , поэтому в самом близком к ядру слое К (п = 1) может находиться не более двух электронов, в слое L (п = 2) - не более восьми и т.д. Чем больше заряд ядра или порядковый номер в таблице, тем сильнее притягиваются электроны, особенно внутренних слоев, поэтому диаметры слоев с ростом номера элемента уменьшаются, и все атомы имеют почти одинаковые размеры порядка 10 - 10 м. Атомы, относящиеся к одной группе элементов таблицы Менделеева, имеют одинаковую валентность, обусловливающую их сходные химические свойства. На внешних оболочках они имеют одинаковое число электронов, которые называются валентными.
Принцип Паули позволил объяснить насыщение уровней. В соответствии со свойствами симметрии-функции при перестановке двух частиц для электронов возможны только антисимметричные состояния. В дальнейшем принцип Паули сыграл решающую роль при построении статистики Ферми-Дирака для частиц с полуцелым спином - фермионов. Для частиц с целым спином (в единицах) - бозонов - была построена статистика Бозе - Эйнштейна. Принцип Паули не имеет аналога в классической физике, и физические причины существования этого запрета не полностью еще понятны. Паули предложил сначала простое правило, автоматически объясняющее наличие групп из 2, 8, 18 и 32 элементов. Он постулировал, что одну электронную орбиталь (или стоячую волну) могут занимать не более двух электронов. Вскоре было обнаружено наличие спина у электрона, и получилось, что принцип Паули имеет основание.
Если идти по системе химических элементов в направлении увеличения их номера, то оказывается, что электронами сначала заполняются наинизшие уровни энергии. Так, атом висмута выглядит так же, как и атом свинца, но с одним отличием - у висмута на 6p -оболочке на один электрон больше. Существует еще одно правило заполнения оболочек - правило Хунда, согласно которому, при заполнении s , p , d и т. д. уровней их сначала занимают электроны с одинаковой ориентацией спина и только потом - с противоположной. Так можно построить модели 92 стабильных атомов Периодической системы химических элементов.
Так, атом азота имеет 7 электронов; из них по два (с «правым» и «левым» спином) располагаются на уровнях \ s и 2s, а остальные три - на уровне 2р, который может вместить только 6 электронов. По правилу Хунда последние три электрона азота имеют одинаковую ориентацию спина. В волновой модели каждому из р-элек тронов соответствует волновая функция из двух симметричных «яйцевидных» половинок; три из них могут быть ориентированы вдоль любой из трех осей прямоугольной системы координат, в результате атом выглядит сферически симметричным. Следующий атом - кислород - должен содержать в одном из этих «p -пространств» еще один электрон с противоположно направленным спином. Это можно представить так: две полностью конгруэнтные p -орбитали проникают друг в друга, совершенно не влияя одна на другую. Периодическая система элементов теряла свою загадочность.
Как известно, природные химические элементы занимают в Периодической таблице места до № 92, т. е. до урана. Более тяжелых элементов нет ни на Земле, ни в метеоритах, приходящих из Космоса. Это и понятно - в ядрах атомов этих элементов больше протонов, значит, ядра таких элементов неустойчивы, а атомы - радиоактивны. Для получения трансурановых элементов были созданы специальные установки, названные циклотронами, в которых создаются мощные пучки а-частиц и более тяжелых частиц для бомбардировки ими урана. Первые циклотроны были созданы в США, где были получены сначала плутоний и нептуний, а затем - вплоть до элемента № 101, который был назван менделевием.
2.2 Химический катализ и методы управления химическими процессами
Реакционная способность вещества на 50 % определяется его составом и структурой и на 50 % - его реагентом по реакции. Так, если реагент - сильная кислота, то вещество ведет себя как основание, и наоборот. Эту двойственность поведения в реакции объяснил Бутлеров, считая, что вещество расщепляется на два изомера и это влияет на равновесную изомерию (таутомерия). Впоследствии А. Н. Несмеянов установил, что это - раздвоение свойств изомера как целого.
К 70-м годам XIX в. идеи и методы физики стали проникать в смежные области естествознания. Н. Н. Бекетов впервые сформулировал и обосновал положение о том, что физическая химия - самостоятельная наука, основная задача которой состоит в изучении связи между физическими и химическими свойствами веществ, явлений и процессов. Работами М.Бертло, Ю.Томсона, В.Ф.Лучинина и Н.Н.Бекетова была создана термохимия, изучающая закономерности в теплоте образования и сгорания веществ в зависимости от их химического строения. Исследования Дж. Гиббса, Я. Г. Вант-Гоффа, В.Г.Нернста и других ученых развили химическую термодинамику, изучающую энергетические процессы, которые сопровождают процессы химические. Гиббс сформулировал правило фаз, по которому система имеет несколько состояний, разделенных между собой границами. Нернст установил, что при приближении к температуре, равной 0 К, тепловой эффект и движущая сила химических реакций все более совпадают и это дает возможность производить точный расчет химических реакций. Начало систематическому расчету реакций положил Н.А. Меншуткин.
Химические реакции - основа химии. При столкновениях молекул может высвободиться энергия, достаточная для перегруппировки электронов в них и формирования нового набора связей, т. е. образования новых соединений. Химические реакции обычно представляют в виде уравнений: слева - исходные вещества, справа - продукты реакции; стрелка обращена в сторону более низкой суммарной энергии связей, показывая, в какую сторону реакция стремится идти самопроизвольно. Но реакции могут идти в обе стороны и представляют собой перераспределение химических связей.
Исследования общих закономерностей, управляющих химическими процессами, заинтересовали возникшую в конце XIX в. химическую индустрию. Если какое-то вещество является катализатором, или ингибитором, происходит целый комплекс реакций, участвуют все вещества, оказавшиеся в зоне реакции, и могут получиться различные побочные продукты. От знания скорости и направления реакций, влияния на них различных факторов зависела производительность химической промышленности. Определение характера химического процесса казалось почти невозможным, пока не создали химическую термодинамику и кинетику.
Ответ на вопрос, от чего зависит возможность осуществления реакции, перестройки химических связей дают законы термодинамики. Например, для получения теплоты требуется определенное топливо. Переход теплоты от нагретого тела связан с распределением энергии: атомы вещества отдают энергию теплового движения окружающим атомам, не меняя своего состояния. При химических реакциях энергия тоже рассеивается, но меняются окружение атомов и исходное вещество, может возникнуть новое вещество. При решении разнообразных термодинамических задач используют особые функции - термодинамические потенциалы. Зная выражение термодинамических потенциалов, через независимые параметры системы можно вычислить и другие характеристики процессов. Приведем некоторые из них.
Термодинамический потенциал равен изменению потенциала, приходящегося на одну частицу в соответствующем процессе. И реакция возможна, если она сопровождается уменьшением величины потенциала. Когда камень падает в поле тяготения, уменьшается его потенциальная энергия. Подобный процесс наблюдается и в химической реакции: когда она идет, ее свободная энергия переходит на более низкий уровень. В этих примерах аналогия полная, поскольку нет изменения энтропии. Но в химических реакциях изменение энтропии необходимо учитывать, и возможность реакции еще не означает, что она пойдет самопроизвольно. Термодинамика объясняет: реакция пойдет только при уменьшении энергии веществ и увеличении энтропии. Энтропия растет, так как в малой молекуле расположение атомов менее упорядочено, чем в большой.
Но реальные процессы и состояния чаще всего являются неравновесными, а системы - открытыми. Такие процессы рассматриваются в неравновесной термодинамике.
Ле Шателье выдвинул принцип подвижного равновесия (1884). Сейчас его формулируют так: внешнее воздействие, которое выводит систему из состояния термодинамического равновесия, вызывает в ней процессы, направленные на ослабление результатов такого влияния. Появилась возможность смещать равновесие в сторону образования продуктов реакции через изменение температуры, давления и концентрации реагентов. Эти методы назвали термодинамическими.
Явление химического катализа было открыто в 1812 г. Кирхгофом. В XVIII в. уже знали о каталитическом действии селитры при получении серной кислоты, хотя смысл этого явления не поддавался объяснению. Берцеллиус связал природу взаимодействия агентов с электрохимическими потенциалами (1835), обозначив силу «вызывания химической деятельности» понятием каталитической силы. Либих предположил, что взаимодействие с катализатором может непрерывно менять химические связи в молекуле. Взгляды Либиха поддержал Д. И. Менделеев. К концу XIX в. поняли, что в реакции участвуют стенки сосуда, растворители и случайные примеси. Целенаправленное изучение катализа позволило к середине XX в. получать широкий круг органических продуктов, регулировать скорость и заданную направленность химических реакций.
Д.П.Коновалов положил начало физико-химической теории катализа, ввел понятие активной поверхности (1885) и вывел формулу для скорости автокаталитических реакций независимо от С. Оствальда. Теорией катализа занимался и Д. И. Менделеев (1886). При катализе происходит активация молекул реагента при контакте с катализатором: связи в веществе становятся более подвижными, «подталкивая» вещества к взаимодействию. В. Оствальд, сравнивая относительную активность различных кислот, пришел к выяснению условий химического равновесия и развитию катализа. Он определил катализатор как вещество, «которое изменяет скорость реакции, но не входит в состав конечного продукта реакции».
Доля каталитических процессов в химической промышленности достигает 80 %. За 50 лет катализ превратился в мощное орудие синтеза веществ. Зависимость скорости реакций от температуры исследовал С.Аррениус, предложивший (1889) закон: вероятность накопления энергии активации определяется формулой, полученной Больцманом:. Вант-Гофф исследовал причины, меняющие скорость реакций, и показал, что с ростом температуры энергия частиц при столкновениях может оказаться достаточной для начала химической реакции. Зная величины энтропии веществ, можно определить условия протекания реакции и ее направление.
Природный катализатор - хлорофилл - комплексное металло-органическое соединение в живой ткани зеленого листа. Поэтому можно считать, что процесс фотосинтеза происходит при фото-биокатализаторе, и эти реакции изучаются в целях получения еще одного источника энергии. За идеями строения эффективных биокатализаторов химики часто обращаются к живой природе. Поэтому будущее катализа - на пути между химией и биологией. Большинство биохимических процессов - каталитические. Расчет энергии активации проводится в квантовой химии.
Биокатализаторы были открыты в начале XX в. Благодаря работам французских химиков П.Сабатье и Ж.Б.Сандерана в промышленности при гидрировании органических веществ вместо благородных металлов стали использовать никель, медь, кобальт, железо. Русский химик-органик В.Н.Ипатьев исследовал каталитическое действие оксидов металлов при высоких давлениях и температурах и установил, что при использовании смеси катализаторов их действие усиливается. Каталитический способ синтеза аммиака из атмосферного азота и водорода под давлением открыл немецкий химик Ф. Габер. Затем химик-технолог К. Бош и А. Митташ предложили промышленный способ синтеза аммиака с использованием смеси катализаторов - железа, едкого калия и глинозема - при повышенных температурах и высоком давлении.
Управлять ходом химической реакции можно и за счет привлечения внешнего источника энергии - световой или тепловой. С ее помощью удается расшатать атомы в исходной молекуле и побудить их к участию в нужной реакции. Этим занимается область химии, получившая название химии экстремальных состояний. Использованием для этой цели более жесткого электромагнитного излучения (для молекул с крепкими внутримолекулярными связями) занимается радиационная химия.
2.3 Цепные реакции и свободные радикалы
Свободный радикал обнаружил в 1900 г. уроженец Украины М. Гомберг, создатель антифриза для автомобилей. Он выделил некое соединение, способное вступать в реакции, и доказал, что оно есть «половина молекулы». До этого считали, что только молекулы и атомы участвуют в химических реакциях. Если происходит реакция типа замещения, то выделяющаяся энергия перераспределяется между продуктами реакции. Но многие реакции идут через промежуточные продукты реакции и энергия активации понижается. Если промежуточные продукты имеют ненасыщенные валентности, это понижение особенно заметно. Такие атомы или соединения называют радикалами и обозначают точкой над символом.
М.Боденштейн обнаружил, что при взаимодействии хлора и водорода один поглощенный фотон света вызывает образование около ста тысяч молекул хлороводорода. Реакция соединения хлора с водородом идет следующим образом:
Первая ненасыщенная валентность при комнатных температурах не образуется, нужно, чтобы с какой-то внешней помощью произошло расщепление молекулы хлора на два атома, после этого реакция самопроизвольно и быстро осуществится по заданной схеме. Каждый раз вместо ненасыщенной валентности одного свободного атома появляется валентность другого атома, и этот процесс происходит поочередно. Реакция идет цепным образом, отсюда название - цепная реакция.
Понятие разветвленных цепных реакций ввели через 10 лет И.А.Кристиансен и Г. А. Крамерс, показав, что цепные реакции могут наблюдаться не только в фотохимических реакциях. Это понятие позднее заимствовали физики для описания ядерных процессов.
Советские ученые Ю.Б.Харитон и А.К.Вальтер, исследуя реакции между парами фосфора и кислородом (1926), не могли понять, почему они не шли при низких и высоких давлениях кислорода, тогда как при средних происходил взрыв. Объяснение этому явлению дал основатель научной школы по химической кинетике Н. Н. Семенов. Причиной является разветвленная цепная реакция, когда вместо одной ненасыщенной валентности получаются несколько.
Окисление водорода, например, идет по такой схеме: (зарождение цепи),(разветвление цепи), (продолжение цепи).
Возникающий на этапе зарождения цепи радикал Н0 2 мало активен. Итак, из одного активного центра с ненасыщенной валентностью Н получаются три гидроксида ОН и два Н. Если последние радикалы Н могут дать вновь по три радикала, то скорость реакции нарастает лавинообразно. Воспрепятствовать этому бурному процессу может только рекомбинация Н на стенках сосуда или переход валентности на неактивный радикал Н0 2 внутри объема. Значит, меняя условия протекания реакции, можно управлять и скоростью ее протекания. При этом важную роль играют размеры сосуда - успеют ли радикалы дойти до стенки и рекомбинировать на ней или разветвление реакции произойдет раньше, закончившись взрывом.
К тем же выводам пришел и английский ученый С.Н.Хиншелвуд, открывший вещества, которые могут реагировать двояко. Близкие идеи относительно классификации процессов воспламенения и предельных явлений при горении ацетилена содержались в монографии Д.В.Алексеева (1915). В ацетилене, например, при медленном нагревании продукты распада группы СН не будут иметь времени для того, чтобы родились известные продукты полимеризациии т. д. При быстром нагревании активные молекулы начнут разлетаться с большими скоростями, при столкновениях дадут начало химическому превращению и процесс будет развиваться от слоя к слою, образуя волну реакции. При малых концентрациях молекул реакция может погаснуть. Значит, процессом горения можно управлять.
Теорию цепных реакций Семенов построил и изложил в монографии «Цепные реакции» (1934). Она охватывала большое число явлений, происходящих при взрывных процессах и горении.
Примером цепной реакции является и реакция деления ядер урана, происходящая аналогично химической, только вместо закона сохранения масс действует закон сохранения и изменения энергии (и массы). Работы, начатые в 1934 г. под руководством Э. Ферми, показали, что ядра атомов большинства элементов способны поглощать медленные нейтроны и становиться радиоактивными.К 1938 г. было обнаружено, что в уране, активизированном нейтронами, присутствует элемент, сходный с танталом. Этому факту есть только одно объяснение - под действием нейтронов атом урана делится на две примерно равные массы. Если в уране отношение числа нейтронов к числу протонов равно 1,6, а в тантале - между 1,2 и 1,4, то при делении обязательно возникнут элементы с «лишними» нейтронами. Это значит, что нейтроны играют роль спичек, возбуждающих реакцию деления.
Гипотеза о существовании атомов, тех неделимых частиц, различные конфигурации которых в пустоте образуют окружающий нас объективный мир, так же стара, как и наша цивилизация:
«На тела основные природа все разлагает» .
Твердые, обладающие массой и неделимые атомы Ньютона; атомы в кинетической теории, средняя кинетическая энергия которых отождествляется с температурой тела; атомы в химии, стройные комбинации которых обнаруживаются в химических реакциях; водородный атом, из различных сочетаний которого Проут составлял все элементы. Понятие атома существует уже по крайней мере 25 столетий, хотя часто оно отодвигалось на второй план или было в загоне.
Но что такое атом? И какой смысл следует вкладывать в этот вопрос? К концу девятнадцатого века, когда завершилось создание классической теории и появились новые технические средства, все
настойчивее стал звучать старый вопрос: какова природа атома? Эта тема и ее вариации стали лейтмотивом физики двадцатого столетия.
На исходе девятнадцатого века было проведено много опытов по изучению электрического разряда в разреженных газах. Разряд возбуждался (с помощью индукционной катушки или электростатической машины, создающих большие разности потенциалов) между отрицательным электродом, названным катодом, и положительным электродом, названным анодом, причем оба электрода запаивались внутрь стеклянной трубки, из которой был откачан воздух. Когда воздух в трубке становился достаточно разреженным, темная область вокруг катода, известная под названием темного круксова пятна, постепенно расширялась, пока не достигала противоположного конца трубки, который начинал после этого светиться, причем цвет свечения зависел от сорта стекла, из которого была сделана трубка.
Если в трубку ввести различные экраны, например, как на фиг. 62, то светиться будет небольшое пятно, расположенное на конце трубки, как будто что-то проходит через отверстия в экране и, достигая стекла, вынуждает его светиться. Это что-то окрестили катодными лучами.
В конце девятнадцатого века происходили оживленные дискуссии о природе этих лучей. Некоторые считали, что лучи, подобно свету, обязаны своим происхождением процессам в эфире; другие же полагали, что они состоят из электрически заряженных частиц. В 1895 г. Жану Перрену удалось собрать эти лучи в изолированном сосуде и доказать, что они несут отрицательный заряд. Вскоре после этого Дж. Дж. Томсон осуществил свой классический эксперимент, в котором он впервые отождествил катодные лучи с частицами, названными позднее электронами. Он писал:
«Эксперименты, описанные в этой статье, были проведены с целью получения некоторой информации о природе катодных лучей. По поводу этих лучей существуют совершенно противоположные точки зрения; согласно почти единодушному мнению германских физиков, они вызываются какими-то процессами в эфире, которым - ввиду того, что их путь в однородном магнитном поле является не прямолинейным, а круговым - ни в одном из ранее наблюдавшихся явлений нет аналога; согласно
другому мнению, эти лучи далеко не эфирного происхождения, а материального и являются просто потоком частиц материи, заряженных отрицательным электричеством» .

Фиг. 63. Схема установки Томсона (взято из ).
Создавая электрическое поле между пластинами, обозначенными на фиг. 63 буквами и или магнитное поле, направленное перпендикулярно направлению распространения лучей, Томсон наблюдал смещение светящегося пятна на конце трубки; чем сильнее были электрическое или магнитное поля, тем больше смещалось пятно. Убедившись, что это явление не зависит от того, какой газ находится в трубке, Томсон писал:
«Поскольку катодные лучи несут отрицательный заряд, отклоняются под действием электростатической силы, как если бы они были отрицательно заряженными, и реагируют на магнитную силу точно так же, как реагировали бы на нее отрицательно заряженные тела, двигавшиеся вдоль линии распространения лучей, я не могу не прийти к заключению, что катодные лучи суть заряды отрицательного электричества, переносимые частицами материи. Тогда встает вопрос: что это за частицы? Являются ли они атомами, молекулами или материей в более тонком состоянии разделения? С целью пролить некоторый свет на этот вопрос я провел целый ряд измерений отношения массы этих частиц к величине заряда, переносимого ими» .
В то же самое время сила, действующая на заряженную частицу со стороны магнитного поля В, перпендикулярного направлению ее движения:
![]()
Если, например, частица заряжена отрицательно, а электрическое поле направлено от к то электрическая сила будет отклонять частицу вниз. Магнитная же сила, действующая на частицу, которая движется в магнитном поле, направленном так, как показано на фиг. 64, будет отклонять частицу вверх: Поэтому, подбирая напряженности электрического и магнитного полей так, чтобы светящееся пятно оставалось несмещенным, Томсон тем самым выравнивал силы, действующие на частицы со стороны электрического и магнитного полей:

Отсюда он узнавал скорость гипотетических частиц. Затем, выключая электрическое поле и варьируя напряженность магнитного поля, он мог изменять величину отклонения частиц в конце трубки. Зная время, в течение которого частицы находились в магнитном поле (так как он знал их скорость), Томсон тем самым мог рассчитать действие на них этого поля. Отсюда по измеренной величине отклонения ему удалось определить отношение заряда частиц к их массе.
В конце концов он получил следующую величину отношения массы к заряду для своих гипотетических частиц
![]()
В заключение Томсон писал:
«Из этих измерений видно, что величина не зависит от природы газа, а ее значение очень мало по сравнению с величиной являющейся наименьшим из ранее известных значений для этого отношения и относящейся к ионам водорода, которые участвуют в электролизе.
Таким образом, величина отношений для носителей электричества в катодных лучах значительно меньше, чем соответствующая величина в электролизе. Малость объясняется либо малостью либо большим значением либо и тем и другим одновременно» .
Этот носитель электричества, активная составная частица катодных лучей, был назван со временем электроном, который явился первой элементарной частицей двадцатого столетия.
Позднее Томсон писал:
«Моя первая попытка отклонить пучок катодных лучей состояла в пропускании их между двумя параллельными металлическими пластинами, укрепленными внутри разрядной трубки, и возбуждении электрического поля между этими пластинами. Таким способом получить регулярное отклонение мне не удалось... Отсутствие отклонения объяснялось наличием в трубке газа (давление оставалось слишком высоким), поэтому было необходимо получить более высокий вакуум. Но это было легче сказать, чем осуществить. Техника получения высокого вакуума в те дни находилась в зачаточном состоянии» .
Уже не в первый раз осуществление решающего эксперимента наталкивалось не на трудности его идейного замысла, а на отсутствие необходимых технических средств.
После измерений Томсона чрезвычайно важно было определить либо величину заряда, либо массу этих частиц по отдельности. Заряд газообразных ионов, измеренный ранее в лаборатории Томсона, равнялся примерно Полагая, что заряд этих ионов такой же, как и заряд, переносимый катодной частицей, нетрудно показать, что масса этих частиц чрезвычайно мала:
![]()
В те годы Томсон называл катодные частицы «корпускулами», или изначальными атомами; слово «электрон» использовалось им для обозначения количества заряда, переносимого «корпускулой». Однако со временем электроном стали называть саму частицу. Значительно позднее (в 1909 г.) Милликен, измеряя величину заряда на капельках масла, установил, что элементарный заряд (предполагалось, что его величина такая же, как и заряд электрона) равен приблизительно Приведем современные значения заряда и массы электрона:
![]()
В 1897 году британским физиком Джозефом Джоном Томсоном (1856-1940) было совершено открытие электрона после серии экспериментов, целью которых было изучения природы электрического разряда в вакууме. Знаменитый ученый интерпретировал отклонения лучей электрически заряженных пластин и магнитов в качестве доказательства того, что электроны гораздо меньше, чем атомы.
Великий физик и ученый должен был стать инженером
Томсон Джозеф Джон, великий и наставник, должен был стать инженером, так считал его отец, однако в то время у семьи не было средств на оплату обучения. Вместо этого молодой Томсон посещал колледж в Мачестере, а затем и в Кембридже. В 1884 году он был назначен на престижную должность профессора экспериментальной физики в Кембридже, хотя сам он лично проводил очень мало экспериментальных работ. Он открыл в себе талант к разработке аппаратуры и диагностировании связанных с этим проблем. Томсон Джозеф Джон был хорошим преподавателем, вдохновлял своих учеников и уделял значительное внимание широкой проблеме развития науки преподавания в университете и средней школе.

Лауреат Нобелевской премии
Томсон получил множество различных наград, включая Нобелевскую премию по физике в 1906 году. Он также имел большое удовольствие видеть, как некоторые из его приближенных получают свои Нобелевские премии, в том числе Резерфорд по химии в 1908 году. Ряд ученых, таких как Уильям Праут и Норман Локьер, предположили, что атомы - это не самые мельчайшие частицы во Вселенной и что они построены из более фундаментальных единиц.

Открытие электрона (кратко)
В 1897 году Томпсон предположил, что одна из основных единиц в 1000 раз меньше атома, эта стала известна как электрон. Учёный обнаружил это, благодаря своим исследованиям о свойствах катодных лучей. Он оценил массу катодных лучей путем измерения тепла, выделяемого при попадании лучей теплового перехода, и сравнил ее с магнитным отклонением луча. Его эксперименты говорят не только о том, что катодные лучи в 1000 раз легче атома водорода, но и то, что их масса была одинаковой вне зависимости от типа атома. Ученый пришел к выводу, что лучи состоят из очень легких, отрицательно заряженных частиц, которые являются универсальным строительным материалом для атомов. Он назвал эти частицы "корпускулы", но позже ученые предпочли название "электроны", предложенное Джорджем Джонстоном Стони в 1891 году.

Опыты Томпсона
Сравнивая отклонение пучков катодных лучей с электрическим и магнитным полями, физик получил более надежные измерения заряда и массы электрона. Опыт Томсона проводился внутри специальных электронно-лучевых трубок. В 1904 году он выдвинул гипотезу о том, что модель атома представляет собой сферу позитивной материи, в которой положение частиц определяется электростатическими силами. Чтобы объяснить в целом нейтральным заряд атома, Томпсон предположил, что корпускулы были распределены в однородном поле положительного заряда. Открытие электрона дало возможность считать, что атом можно разделить на еще более мелкие части, и стало первым шагом к созданию детальной модели атома.

История открытия
Джозеф Джон Томсон широко известен как первооткрыватель электрона. Большую часть своей карьеры профессор работал над различными аспектами проводимости электричества через газы. В 1897 (год открытия электрона) он экспериментально доказал, что так называемые катодные лучи на самом деле являются отрицательно заряженными частицами в движении.
Много интересных вопросов связано непосредственно с процессом открытия. Очевидно, что характеристиками катодных лучей занимались еще до Томсона, и несколько ученых уже внесли свой важный вклад. Можно ли тогда с точностью сказать, что именно Томсон был первым, кто обнаружил электрон? Ведь он не изобрел вакуумную трубку или наличие катодных лучей. Открытие электрона - это чисто кумулятивный процесс. Кредитуемый первооткрыватель вносит важнейший вклад, обобщая и систематизируя весь накопленный до него опыт.

Электронно-лучевые трубки Томсона
Великое открытие электрона было сделано при помощи специального оборудования и при определенных условиях. Томсоном была проведена серия экспериментов с использованием продуманной электронно-лучевой трубки, которая включает в себя две пластины, между ними должны были путешествовать лучи. Были приостановлены давние споры относительно природы катодных лучей, возникающих при прохождении электрического тока через сосуд, из которого была откачана большая часть воздуха.

Этим сосудом была электронно-лучевая трубка. Применяя усовершенствованный вакуумный метод, Томсон смог выдвинуть убедительный аргумент о том, что эти лучи состоят из частиц, независимо от вида газа и типа металла, который использовался в качестве проводника. Томсона по праву можно назвать человеком, который расщепил атом.

Научный затворник? Это не про Томсона
Выдающийся физик своего времени отнюдь не был научным затворником, как часто думают про гениальных ученых. Он был административным руководителем очень успешной Кавендишской лаборатории. Именно там учёный познакомился с Роз Элизабет Пэджет, на которой и женился в 1890 году.
Томсон не только управлял рядом исследовательских проектов, он также финансировал реконструкцию лабораторных помещений с небольшой поддержкой от университета и колледжей. Это был талантливый педагог. Люди, которых он собирал вокруг себя с 1895 по 1914 годы, приезжали во всех сторон света. Некоторые из них под его началом получили семь Нобелевских премий.

Именно при работе с Томсоном в Кавендишской лаборатории в 1910 году провел исследования, которые привели к современному пониманию внутренней
Томсон очень серьезно относился к своей преподавательской деятельности: он регулярно читал лекции в начальных классах утром и преподавал науку аспирантам днем. Учёный считал учение полезным для исследователя, поскольку оно требует периодически пересматривать базовые идеи и одновременно оставлять место для возможности открытия чего-то нового, на что раньше никто не обращал внимания. История открытия электрона это наглядно подтверждает. Большую часть своей научной деятельности Томпсон посвятил изучению прохождения электрически заряженных частиц тока сквозь и вакуумное пространство. Он занимался исследованием катодных и рентгеновских лучей и внес огромный вклад в изучение физики атома. Кроме этого, Томсоном была также разработана теория движения электронов в магнитном и электрическом полях.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
«История открытия электрона»
Предпосылки открытия, гипотезы
В 1749 году Бенджамин Франклин высказал гипотезу, что электричество представляет собой своеобразную материальную субстанцию. Центральную роль электрической материи он отводил представлению об атомистическом строении электрического флюида. В работах Франклина впервые появляются термины: заряд, разряд, положительный заряд, отрицательный заряд, конденсатор, батарея, частицы электричества.
Иоганн Риттер в 1801 году высказал мысль о дискретной, зернистой структуре электричества.
Вильгельм Вебер в своих работах с 1846 года вводит понятие атома электричества и гипотезу, что его движением вокруг материального ядра можно объяснить тепловыми и световыми явлениями.
Майкл Фарадей ввел термин «ион» для носителей электричества в электролите и предположил, что ион обладает неизменным зарядом. Г. Гельмгольц в1881 году показал, что концепция Фарадея должна быть согласована с уравнениями Максвелла. Джордж Стоней в 1881 году впервые рассчитал заряд одновалентного иона при электролизе, а в 1891 году, в одной из теоретических работ Стоней предложил термин «электрон» для обозначения электрического заряда одновалентного иона при электролизе.
История открытия электрона
Когда Левкипп и его ученик Демокрит впервые ввели понятие «атом», они представляли себе его как конечную неделимую частицу вещества. Более двух тысячелетий спустя Дальтон поддержал эту точку зрения. Согласно такому определению, атом не должен иметь внутренней структуры. Ведь если какой-то атом можно разделить на более мелкие частицы, то истинными атомами будут именно эти частицы.
На протяжении всего XIX в. атом считался неделимым, лишенным каких-либо характерных особенностей и не имеющим внутренней структуры. Однако после проведения ряда экспериментов, которые по своей природе даже не были химическими, эта точка зрения была отвергнута. К ломке старых представлений привело изучение электрического тока.
Как известно, между положительно и отрицательно заряженными точками устанавливается электрическое напряжение. Под действием такого напряжения заряды перемещаются от точки с большим потенциалом к точке с меньшим потенциалом. Таким образом, возникает электрический ток, который стремится выровнять разность потенциалов между двумя точками электрического поля.
Первые исследователи электричества в своих еще не очень серьезно обоснованных экспериментах установили, что некоторые жидкости, например растворы солей, проводят электрический ток сравнительно легко. Молния -- электрический разряд, образующийся во время грозы,-- мгновенно распространяется через толщу воздуха в несколько километров.
Экспериментаторам XIX в. представлялось весьма заманчивым попытаться пропустить ток через вакуум. Но чтобы результаты такого эксперимента были надежными, необходимо было получить достаточно глубокий вакуум. Попытки Фарадея пропустить электрический ток через вакуум окончились неудачей только потому, что ему не удалось получить достаточно глубокого вакуума.
В 1855 г. немецкий стеклодув Генрих Гейслер изготовил стеклянные сосуды особой формы и вакуумировал их им же изобретенным способом. Его друг немецкий физик и математик Юлиус Плюккер использовал эти трубки Гейслера для изучения электрических разрядов в вакууме и газах.
Плюккер впаял в трубки дня электрода, создал между ними электрический потенциал и получил электрический ток. Под действием тока в трубках возникало свечение («эффект накаливания»), характер которого зависел от глубины вакуума. При достаточно глубоком вакууме свечение в трубке исчезало, и только вблизи анода было заметно зеленое свечение стекла трубки.
Приблизительно в 1875 г. английский физик Уильям Крукс (1832--1919) сконструировал трубки, в которых можно было получить более глубокий вакуум (трубки Крукса). Исследовать электрический ток, проходящий через вакуум, стало удобнее. Казалось совершенно очевидным, что электрический ток возникает на катоде и движется к аноду, где он ударяется в окружающее анод стекло и создает свечение. Чтобы доказать справедливость такого понимания явления, Крукс помещал в трубку кусок металла, при этом на стекле на противоположном от катода конце появлялась тень. Однако в то время физики не знали, что представляет собой электрический ток. Они не могли вполне определенно сказать, что же все-таки движется от катода к аноду, правда им доподлинно было известно, что этот поток движется прямолинейно (поскольку тень от металла была четко очерчена). Не придя ни к какому выводу относительно природы этого явления, физики отнесли его к «излучению», и в 1876 г. немецкий физик Эуген Гольдштейн (1850--1930) назвал этот поток катодными лучами.
Естественно предположить, что катодные лучи представляют собой какую-то форму света, обладающую волновым характером. Волны, подобно свету, распространяются прямолинейно и, подобно свету, не испытывают влияния сил тяготения. В то же время катодные лучи вполне могут представлять собой частицы, движущиеся с огромной скоростью. Поскольку масса этих частиц чрезвычайно мала или поскольку они движутся чрезвычайно быстро (или и по той, и по другой причине), они или вообще не испытывают действия силы тяжести, или же это действие не проявляется в сколько-нибудь заметной степени. В течение нескольких десятилетий ученые не могли прийти к единому мнению относительно природы катодных лучей. Причем немецкие физики решительно выступали за то, чтобы считать катодные лучи колебаниями, а английские физики столь же решительно настаивали на том, что катодные лучи -- это частицы.
Решить этот спор можно было бы, попытавшись установить, отклоняются ли катодные лучи под действием магнитного поля.
Сам Плюккер и независимо от него Крукс показали, что такое отклонение существует. Оставалось решить еще один вопрос. Если катодные лучи представляют собой заряженные частицы, то электрическое поле также должно их отклонять. Однако доказать, что катодные лучи отклоняются в электрическом поле, удалось далеко не сразу. Только в 1897 г, английский физик Джозеф Джон Томсон (1856--1940), работая с трубками с очень глубоким вакуумом, сумел в конце концов показать, что катодные лучи отклоняются под действием электрического поля.
Рис. 1
Это было последним звеном в цепи доказательств, и теперь оставалось лишь согласиться с тем фактом, что катодные лучи представляют собой поток отрицательно заряженных частиц. Величина отклонения частицы в магнитном поле заданной напряженности определяется массой частицы и величиной ее электрического заряда. Томсону удалось измерить соотношение массы и заряда частицы, хотя измерить эти величины отдельно он не смог.
Как известно, наименьшей массой обладает атом водорода, и если предположить, что частица катодных лучей имеет такую же массу, то электрический заряд ее должен быть в сотни раз больше, чем наименьший известный заряд (заряд иона водорода). В то же время если предположить, что заряд частицы катодных лучей равен минимальному заряду, наблюдаемому у ионов, то в этом случае масса частицы должна быть во много раз меньше массы атома водорода. Поскольку Томсон определил только соотношение массы и заряда, то равновероятны были оба варианта.
Тем не менее имелись веские причины считать, что частица катодных лучей намного меньше любого атома. В 1911 г. американский физик Роберт Эндрюс Милликен (1868--1953) измерил, вполне точно, минимальный электрический заряд, который может нести частица, и тем самым доказал справедливость такого предположения.
Если частица катодных лучей несет такой минимальный заряд, ее масса должна составлять лишь 1/1837 массы атома водорода. Таким образом, была открыта первая из субатомных частиц.
Еще со времени открытия законов электролиза Фарадея бытовало представление, что электричество может переноситься частицами. В 1891 г. ирландский физик Джордж Джонстон Стоуни даже предложил название основной единицы электричества, он предложил называть ее электроном. Итак, в результате изучения катодных лучей был открыт «атом электричества», о котором ученые думали и гадали более полувека. Учитывая важность работы Дж. Дж. Томсона, его можно считать первооткрывателем электрона.
Опыт Томсона
С 1895 года Джозеф Джон Томсон в Кавендишской лаборатории Кембриджского университета начинает методическое количественное изучение отклонения катодных лучей в электрических и магнитных полях. Итоги этой работы были опубликованы в 1897 г. в октябрьском номере журнала «Philosophical Magazine». В своем опыте Томсон доказал, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. Суть опытов и гипотезу о существовании материи в состоянии ещё более тонкого дробления, чем атомы, Томсон изложил на вечернем заседании Королевского общества 29 апреля 1897 г. Извлечение из этого сообщения было опубликовано в «Electrican» 21 мая 1897 г. За это открытие Томсон в 1906 году получил Нобелевску премию по физике.
Опыт Томсона заключался в изучении пучков катодных лучей, проходящих через систему параллельных металлических пластин, создававших электрическое поле и систем катушек, создававших магнитное поле. Обнаружено, что лучи отклонялись при действии отдельно обоих полей, а при определенном соотношении между ними пучки не изменяли прямой траектории. Это соотношение полей зависело от скорости частиц. Проведя ряд измерений, Томсон выяснил, что скорость движения частиц гораздо ниже скорости света -- таким образом было показано, что частицы должны обладать массой. Далее было выдвинуто предположение о наличии этих частиц в атомах и предложена модель атома, впоследствии развитая в опытах Резерфорда.
Модель Томсона.
Рис. 2 Модель Томсона
Заслугой Томсона явилось доказательство того, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. С помощью разрядной трубки особого типа,Томсон измерил скорость и отношение заряда к массе частиц катодных лучей, позднее названных электронами. Электроны вылетали из катода под действием высоковольтного разряда в трубке. Через диафрагмы D и E проходили только те из них, что летели вдоль оси трубки.
Отношение заряда к массе. Трубка, использованная английским физиком Дж.Томсоном для определения отношения заряда к массе для катодных лучей. Эти опыты привели к открытию электрона.
В нормальном режиме эти электроны попадали в центр люминесцентного экрана. (Трубка Томсона была первой «электронно-лучевой трубкой» с экраном, предшественницей телевизионного кинескопа.) В трубке находилась также пара пластин электрического конденсатора, которые, если на них подавалось напряжение, могли отклонять электроны.
Кроме того, в той же области трубки с помощью пары катушек с током могло создаваться магнитное поле, способное отклонять электроны в противоположном направлении. Сила, действующая со стороны магнитного поля, пропорциональна напряженности поля, скорости частицы и ее заряду. Томсон отрегулировал электрическое и магнитное поля так, чтобы полное отклонение электронов было равно нулю, т.е. электронный пучок вернулся в первоначальное положение. электрон атом томсон франклин
Томсон установил, что эта скорость зависит от напряжения на трубке и что кинетическая энергия электронов прямо пропорциональна этому напряжению. Комбинируя уравнения с выражением для скорости электрона, он нашел отношение заряда к массе.
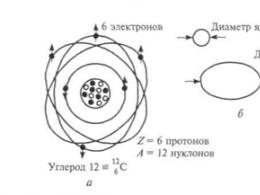
Эксперименты Томсона показали, что электроны в электрических разрядах могут возникать из любого вещества. Поскольку все электроны одинаковы, элементы должны различаться лишь числом электронов. Кроме того, малая величина массы электронов указывала на то, что масса атома сосредоточена не в них. Дж. Томсон, внесший огромный вклад в экспериментальное изучение строения атома, стремился найти модель, которая позволила бы объяснить все его известные свойства. Поскольку преобладающая доля массы атома сосредоточена в его положительно заряженной части, он принял, что атом представляет собой сферическое распределение положительного заряда радиусом примерно 10-10 м, а на его поверхности находятся электроны, удерживаемые упругими силами, позволяющими им колебаться (рис. 3). Суммарный отрицательный заряд электронов в точности компенсирует положительный заряд, так что атом электрически нейтрален. Электроны находятся на сфере, но могут совершать простые гармонические колебания относительно положения равновесия.
Рис. 3 Атом, согласно модели Томсона (модель известна как «Пудинг с изюмом»)
Такие колебания могут происходить лишь с определенными частотами, которым соответствуют узкие спектральные линии, наблюдающиеся в газоразрядных трубках. Электроны можно довольно легко выбить с их позиций, в результате чего возникают положительно заряженные «ионы», из которых состоят «каналовые лучи» в опытах с масс-спектрографом. X-лучи соответствуют очень высоким обертонам основных колебаний электронов. Альфа-частицы, возникающие при радиоактивных превращениях, - это часть положительной сферы, выбитая из нее в результате какого-то энергичного разрывания атома. Электроны удерживаются внутри положительно заряженной сферы упругими силами. Те из них, которые находятся на поверхности, могут довольно легко «выбиваться», оставляя ионизованный атом. Однако эта модель вызывала ряд возражений.
Открытие электрона оказало колоссальное влияние на развитие современной физики, привело к раскрытию механизма излучения и поглощения электромагнитной энергии, механизма взаимодействия электромагнитных волн с веществом. Электрон стал в наши дни фундаментом грандиозного здания электроники.
Электрон оказался не только объектом, но и средством излучения свойств материи. Наглядным примером этому является бурное развитие ускорительной техники.
Использованная литература
1) http://allchem.ru/pages/history/104
2)https://ru.wikipedia.org/wiki/%D0%9E%D1%82%D0%BA%D1%80%D1%8B%D1%82%D0%B8%D0%B5_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%B0
3) http://element y.ru/trefil/19
4) http://www.krugosvet.ru/enc/nauka_i_tehnika/fizika/FIZIKA
Размещено на Allbest.ru
...Подобные документы
Предпосылки и история развития процесса открытия электрона. Опыты Томсона и Резерфорда и методы открытия электрона. Метод Милликена: описание установки, вычисление элементарного заряда. Метод визуализации Комптона. Научное значение открытия электрона.
реферат , добавлен 21.05.2008
Модели строения атома. Формы атомных орбиталей. Энергетические уровни атома. Атомная орбиталь как область вокруг ядра атома, в которой наиболее вероятно нахождение электрона. Понятие протона, нейтрона и электрона. Суть планетарной модели строения атома.
презентация , добавлен 12.09.2013
История открытия радиоактивности, модель атома Томсона. Опыты Резерфорда по рассеянию альфа-частиц. Правило квантования Бора-Зоммерфельда. Боровская теория водородоподобного атома, схема его энергетических уровней. Оптические спектры испускания атомов.
презентация , добавлен 23.08.2013
Экспериментальное наблюдение характеристического излучения атома натрия в возбуждённом состоянии - в процессе горения; определение длины волны и энергетического уровня перехода наружного электрона, которым обусловлен характеристический цвет излучения.
практическая работа , добавлен 07.12.2010
Состояние электрона в атоме, его описание набором независимых квантовых чисел. Определение энергетических уровней электрона в атоме с помощью главного квантового числа. Вероятность обнаружения электрона в разных частях атома. Понятие спина электрона.
презентация , добавлен 28.07.2015
Кинетическая энергия электрона. Дейбролевская и комптоновская длина волны. Масса покоя электрона. Расстояние электрона от ядра в невозбужденном атоме водорода. Видимая область линий спектра атома водорода. Дефект массы и удельная энергия связи дейтерия.
контрольная работа , добавлен 12.06.2013
Классическая модель строения атома. Понятие орбиты электрона. Набор возможных дискретных частот. Водородоподобные системы по Бору. Недостатки теории Бора. Значение квантовых чисел. Спектр излучения атомов. Ширина спектральных линий. Доплеровское уширение.
реферат , добавлен 14.01.2009
История зарождения и развития атомистической теории. Представления Платона и Аристотеля о непрерывности материи. Корпускулярно-кинетическая теория тепла, открытие радиоактивности. Ранняя планетарная модель атома Нагаоки. Определение заряда электрона.
презентация , добавлен 28.08.2013
Энергия отдачи ядер. Излучениеми релятивистские эффекты. Скорость движения электрона вдали от ядра. Кинетическая энергия образовавшегося иона. Длина волны гамма квантов, волны света. Скорость пиона до распада. Уровни энергии электрона в атоме водорода.
реферат , добавлен 22.11.2011
Характеристика электрона в стационарных состояниях. Условие ортогональности сферических функций. Решения для радиальной функции. Схема энергетических состояний атома водорода и сериальные закономерности. Поправки, обусловленные спином электрона.
Дж.Дж.Томсон и его вклад в развитие
физики
XX века
К 150-летию со дня рождения
Сто пятьдесят лет тому назад в Англии, в семье манчестерского букиниста, родился мальчик, который стал одним из виднейших учёных-физиков конца XIX – начала XX вв. Произошло это 18 декабря 1856 г., и ребёнком этим был Джозеф Джон Томсон . Вклад его в развитие физики впечатляет: экспериментальное открытие в 1897 г. электрона, отмеченное Нобелевской премией по физике (1906 г.); одна из первых моделей атома, в состав которой были включены электроны (1903 г.); первые опытные доказательства существования изотопов (1912 г.), создание крупной научной школы физиков, самым ярким представителем которой является Эрнест Резерфорд, – таков далеко не полный перечень того, что сделал в науке за свою долгую жизнь этот человек. Вот почему в год его юбилея представляется важным не только вспомнить о его научном наследии, но и попытаться оценить значение этого наследия для современности. И есть ещё одна причина. В сознании многих людей – как физиков-профессионалов, так и просто тех, кто интересуется историей науки, – имя этого учёного, которого современники кратко называли «Джи-Джи», с одной стороны, зачастую затмевается именами многих других выдающихся физиков минувшего столетия, а с другой стороны, ему порой ошибочно приписывают научные заслуги его старшего современника – Уильяма Томсона (1824–1907), получившего в 1892 г. за выдающиеся научные заслуги титул лорда Кельвина (отметим, что последний не только предложил абсолютную шкалу температур, но и установил в 1853 г. изучаемую ныне в школе формулу Томсона для периода колебаний в колебательном контуре). Это обстоятельство также является причиной, по которой о Дж.Дж.Томсоне следует поговорить особо.
В юности Томсон хотел стать инженером и даже поступил в один из манчестерских колледжей соответствующего профиля. Но вскоре из-за смерти отца он был вынужден по причине недостатка средств прервать обучение инженерному делу. «Однако, изучив математику, физику и химию, ему в 1876 г. удалось получить стипендию в Тринити*-колледже, и именно с Кембриджским университетом связана вся дальнейшая академическая жизнь Томсона» . (*Слово «Trinity » в переводе с англ. означает «Троица», т.е. Тринити-колледж – это «Колледж св. Троицы».)
Университет Томсон окончил в 1880 г., и к этому времени (началу 90-х гг. XIX в.) относятся его первые научные работы. Они посвящены развитию электродинамики Максвелла. Так, решая задачу о движении заряженного шара, Томсон пришёл к выводу об увеличении кажущейся массы заряда за счёт энергии электростатического поля, и этот вывод получил своё дальнейшее развитие в начале ХХ в. в специальной теории относительности, в частности, в работах А.Пуанкаре. В 1884 г., в возрасте 28 лет, Томсон стал директором Кавендишевской лаборатории, сменив на этом посту Дж.У.Рэлея, и директорство продолжалось до 1918 г. А спустя год, в 1885 г., Томсон защитил диссертацию под названием «О некоторых приложениях принципов динамики к физическим явлениям», которую впоследствии Г.Герц называл «замечательным трактатом»: «Автор развивает здесь следствия динамики, которые наряду с ньютоновскими законами движения имеют в своей основе новые, не выраженные чётко предпосылки. Я мог бы примкнуть к этому трактату; фактически же моё собственное исследование уже значительно продвинулось, прежде чем я познакомился с этим трактатом» , – так писал о диссертации Томсона Герц в последний год своей жизни в предисловии к книге «Принципы механики, изложенные в новой связи» (1894).
Открытие электрона
1. Предыстория. В своей статье «Научная деятельность Вениамина Франклина» (1956) академик П.Л.Капица цитирует фрагмент одного из его писем, датированного 1749 г.: «Электрическая материя состоит из частиц крайне малых, т.к. они могут пронизывать обычные вещества, такие плотные, как металл, с такой лёгкостью и свободой, что не испытывают заметного сопротивления». Комментируя эти слова, П.Л.Капица пишет: «В наши дни мы называем эти „крайне малые частицы” электронами. Далее Франклин рассматривал любое тело как губку, насыщенную этими частицами электричества. Электризация тел состоит в том, что тело, имеющее избыток электрических частиц, положительно заряжено; если тело имеет недостаток этих частиц, оно заряжено отрицательно» .
Таким образом, догадки о существовании частиц, являющихся носителями электрического заряда, высказывались ещё в XVIII в. Первую попытку построения электродинамики, основанной на представлении о зернистом строении «электрического флюида» предпринял в 40-е гг. XIX в. немецкий физик Вильгельм Эдуард Вебер (1804–1891), который считал эти частицы невесомыми и именовал их «электрическими массами», по сути, отождествляя термин «масса» с термином «заряд». В электродинамике Максвелла, разрабатывавшейся им в основном в 60-е гг. XIX в. о подобного рода частицах не упоминается: в ней господствует полевой подход, и электричество трактуется как перемещающаяся в проводниках некая несжимаемая жидкость. Попытку привнести идею дискретности электрических зарядов в электродинамику Максвелла предпринял впервые в 1878 г. Г.Лоренц. Так, в 1892 г. в работе «Электромагнитная теория Максвелла и её приложение к движущимся телам» Лоренц писал: «Достаточно будет допустить, что все весомые тела содержат множество маленьких частиц, заряженных положительно или отрицательно, и что все электрические явления вызываются смещением этих частиц. Согласно этому представлению электрический заряд обусловлен избытком частиц одного определённого знака, электрический ток обусловлен потоком этих частичек, а в весомых изоляторах имеет место „диэлектрическое смещение”, если содержащиеся в них наэлектризованные частицы оказываются удалёнными от своих положений равновесия.
Эти гипотезы не содержат ничего нового в отношении электролитов, и они представляют известную аналогию с идеями относительно металлических проводников, бытовавших в старой теории электричества. От атомов электрической жидкости до заряженных корпускул не так уже далеко» .
Особо следует отметить исследования, касавшиеся особенностей электрических явлений в разреженных газах. В 70-е гг. немецкий физик Эуген Гольдштейн (1850–1930) ввёл в физику понятие катодных лучей и предположил, что по своей природе они аналогичны свету с той лишь разницей, что свет испускается телом вокруг себя по всем направлениям, а катодные лучи испускаются лишь перпендикулярно поверхности катода, но оба процесса по природе относятся к волновым. Опыты Гольдштейна в конце 70-х гг. XIX в. в усовершенствованном виде повторил выдающийся английский физик Уильям Крукс (1832–1919). Введя в газоразрядную трубку радиометр, им же сконструированный ещё в 1873 г., Крукс обнаружил его вращение под действием катодных лучей, из чего сделал вывод, что эти лучи переносят энергию и импульс. Поместив в трубку на пути катодных лучей металлический крест, Крукс обнаружил его тень на флуоресцирующем стекле трубки и пришёл к заключению, что катодные лучи распространяются прямолинейно. Он же опытным путём убедился в том, что эти лучи можно отклонять в ту или в другую сторону магнитом. Лучи он именовал неким четвёртым или ультрагазообразным состоянием вещества, либо лучистой материей , имеющей, однако, корпускулярную природу, трактуемую в космическом масштабе: «При изучении этого четвёртого состояния вещества создаётся представление, что мы имеем наконец в своём распоряжении „окончательные” частицы, которые мы можем с полным основанием считать лежащими в основе физики Вселенной» .
Корпускулярной концепции природы катодных лучей противостояла уже упоминавшаяся волновая концепция. Крукс полагал, что катодные лучи есть молекулы остаточного газа, содержащегося в газоразрядной трубке; соприкоснувшись с катодом, они получают от него отрицательный заряд и отталкиваются от катода. Но тогда они должны отклоняться электрическим полем. Опыты же, которые проводил Г.Герц, показали, что электрическим полем они не отклоняются. В 1892 г. Герц опытным путём убедился в том, что катодные лучи могут проходить сквозь тонкие алюминиевые пластинки. Но если это так, то непонятно, каким образом наэлектризованные молекулы могут проходить сквозь металл. С другой стороны, магнитное поле на световые волны не действует, а опыты Крукса показывали, что данное поле действует на катодные лучи. Таким образом, в начале 90-х гг. XIX в. возникла проблема, которая нуждалась в разрешении. Что есть катодные лучи – волны или частицы?
2. Ж.Перрен и Дж.Томсон – решение проблемы природы катодных лучей . На рис. 1 показана схема опыта, который осуществил в 1895 г. Жан Батист Перрен (1870–1942). Внутри разрядной трубки перед катодом N на расстоянии 10 см помещался соединённый с электроскопом металлический цилиндр ABCD (закрытый кожухом EFGH ) с небольшим отверстием напротив катода. При работе трубки в цилиндр проникал пучок катодных лучей, при этом цилиндр всегда получал отрицательный заряд. Если с помощью магнита отклоняли катодные лучи так, чтобы они не попадали внутрь цилиндра, электроскоп не давал никаких показаний. Уже отсюда можно было заключить, что катодные лучи несут отрицательные электрические заряды, а стало быть речь идёт о потоке частиц.
Однако сторонники волновой концепции выдвигали следующее возражение. Допуская, что катод может излучать заряженные частицы, они отрицали, что именно эти частицы являются катодными лучами. При попадании катодных лучей на стенку трубки последняя начинала светиться, но свечение и выброс катодом частицы, по их мнению, могли быть двумя разными явлениями, подобно тому как разными явлениями являются вылет из ствола орудия артиллерийского снаряда и сопровождающая это процесс вспышка.
Требовалось экспериментально доказать, что выброс катодом заряженных частиц и свечение стенки разрядной трубки взаимосвязаны, что речь идёт не о разных физических явлениях, а об одном. Эти доказательства и были представлены Дж.Дж.Томсоном в его опытах 1897 г., являвшихся вариантами опытов Перрена. Цилиндр с отверстием располагался не перед катодом, а сбоку от него, для чего была изменена геометрия самой трубки, рис. 2. В этом случае изначально наблюдалась флуоресценция стеклянной стенки трубки, но она исчезала, когда катодные лучи отклоняли магнитом и «уводили» в отверстие цилиндра, связанного с электроскопом, который регистрировал отрицательный заряд. Так было доказано, что свечение стенки трубки и зарядку цилиндра вызывают одни и те же частицы. А кроме того, Томсон в своих опытах сумел сделать то, что не удалось сделать Герцу: он сумел добиться отклонения катодных лучей электрическим полем (в опытах Герца всё портила проводимость остаточного газа в трубке, возникавшая под действием катодных лучей).

Итак, катодные лучи есть частицы. Какие? Каковы их свойства, их особенности? На эти вопросы Томсон отвечал, описывая их движение законами механики. Например, в электростатическом поле они должны вести себя так же, как ведут себя падающие тела вблизи поверхности Земли. Если, например, положительно заряженная частица оказывается в пространстве между двумя горизонтальными пластинами, верхняя из которых заряжена положительно, а нижняя отрицательно, то эта частица будет отталкиваться от верхней пластины и притягиваться к нижней, т.е. двигаться с ускорением вниз. Если эта частица влетает в пространство между этими пластинами со скоростью, направленной параллельно плоскостям пластин, то она будет приближаться к нижней пластине по параболической траектории, т.е. двигаться так же, как падает на поверхность Земли камень, брошенный со скоростью, направленной параллельно земной поверхности. Если же в пространстве между пластинами существует ещё и магнитное поле, направленное либо за чертёж, либо из чертежа то, во-первых, на исследуемую заряженную частицу будет действовать сила Лоренца (магнитная сила), и по её направлению можно судить о знаке заряда, а во-вторых, электрическая и магнитная силы могут компенсировать друг друга, если окажутся направленными в противоположные стороны. Электрическая сила вычисляется как произведение заряда частицы на напряжённость электрического поля; магнитная сила вычисляется как произведение этого заряда на скорость частицы и на индукцию магнитного поля (пусть угол между векторами скорости и индукции составляет 90°). Тогда получаем eE = e B , т.е. E = B . Отсюда сразу видно, что скорость движения заряженной частицы вычисляется, как отношение напряжённости электрического поля E к индукции магнитного поля B . Однако известно, что сила Лоренца сообщает заряженной частице центростремительное ускорение 2 /r ; тогда и можно найти значение удельного заряда частицы, т.е. отношение заряда к массе частицы:
![]()
Из этого результата видно следующее. Удельный заряд исследуемой частицы зависит от индукции магнитного поля и от напряжённости электрического поля (т.е. от разности потенциалов между пластинами). Удельный заряд частицы не зависит от химических свойств остаточного газа в трубке, от геометрической формы трубки, от материала, из которого изготовлены электроды, от скорости катодных лучей (в опытах Томсона 1897 г. эта скорость составляла 0,1с , где с – скорость света в вакууме) и ни от каких иных физических параметров. Катодные лучи не являются ионами остаточного газа, вылетающими с катода, как полагал Крукс, но всё же это частицы. И если их удельный заряд – константа, то речь идёт об одинаковых частицах. Выразив массу этих частиц в граммах, а заряд в СГСМ, как это было принято в те времена, Томсон получил удельный заряд частиц равным 1,7 10 7 ед. СГСМ/г. О высокой точности его эксперимента говорит то, что современное значение удельного заряда электрона равно (1,76 ± 0,002)10 7 ед. СГСМ/г.
Исходя из полученного значения удельного заряда можно было попытаться оценить массу частиц. Ко времени проведения опытов уже было известно значение удельного заряда иона водорода (10 4 ед. СГСМ/г). Термин «электрон» к тому времени также существовал, его ввёл в обиход в 1891 г. ирландский физик и математик Джордж Стоней (1826–1911) для обозначения электрического заряда одновалентного иона при электролизе, а после исследований Томсона этот термин был перенесён на открытые им частицы. И если предположить, что заряд и масса электрона так или иначе связаны с соответствующими значениями для иона водорода, то были возможны два варианта:
а ) масса электрона равна массе иона водорода, – тогда заряд электрона должен быть больше, чем заряд иона водорода, в 10 3 раз. Однако исследования немецкого физика Филиппа Ленарда показали нереальность подобного предположения. Им было установлено, что средний свободный пробег частиц, образующих катодные лучи, составляет в воздухе 0,5 см, в то время как для иона водорода он меньше, чем 10 –5 см. Значит, масса вновь открытых частиц должна быть малой;
б ) заряд частицы равен заряду иона водорода, но в таком случае масса данной частицы должна быть меньше массы иона водорода в 10 3 раз. На этом варианте остановился Томсон.
Всё же было бы лучше каким-то образом напрямую измерить либо заряд электрона, либо его массу. Решению проблемы помогло следующее обстоятельство. В том же 1897 г., когда Томсон ставил свои опыты по изучению катодных лучей, его ученик Чарльз Вильсон установил, что в воздухе, пересыщенном водяными парами, каждый ион становится центром конденсации пара: ион притягивает к себе капельки пара, и начинается образование капельки воды, которая растёт до тех пор, пока не станет видимой. (В дальнейшем, в 1911 г., сам Вильсон использовал это открытие, создав свой знаменитый прибор – камеру Вильсона). Томсон воспользовался открытием своего ученика так. Допустим, что в ионизированном газе есть некоторое количество ионов, имеющих одинаковый заряд, и эти ионы движутся с известной скоростью . Быстрое расширение газа приводит к его перенасыщению, и каждый ион становится центром конденсации. Сила тока равна произведению числа ионов на заряд каждого иона и на его скорость . Сила тока может быть измерена, скорость движения ионов тоже, и если как-то определить число частиц, то можно найти и заряд одной частицы. Для этого, во-первых, измерялась масса сконденсировавшегося водяного пара, а во-вторых, масса одиночной капельки. Последняя находилась следующим образом. Рассматривалось падение капелек в воздухе. Скорость этого падения под действием силы тяжести равна, по формуле Стокса,
![]()
– коэффициент вязкости среды, в которой падает капля, т.е. воздуха. Зная эту скорость, можно найти радиус капельки r и её объём, полагая капельку сферической. Умножив этот объём на плотность воды, находим массу одной капельки. Разделив общую массу сконденсированной жидкости на массу одной капельки, найдём их число, которое равно числу ионов газа, через которое находится заряд одного иона. Как среднее большого числа измерений Томсон получил для искомого заряда значение 6,5 10 –10 ед. СГСМ, что вполне удовлетворительно согласовывалось с уже известным в то время зарядом иона водорода.
Метод, о котором говорилось выше, был усовершенствован Вильсоном в 1899 г. Над отрицательно заряженной капелькой располагалась положительно заряженная пластина, которая своим притяжением уравновешивала действующую на каплю силу тяжести. Из этого условия можно было найти заряд ядра конденсации. Уместен вопрос: является ли в действительности заряд капли зарядом электрона? Разве это не заряд ионизованных молекул, который отнюдь не обязан быть априори равен заряду электрона? Томсон показал, что заряд ионизованной молекулы действительно равен заряду электрона, появляется независимо от способа ионизации вещества и всегда оказывается равным заряду одновалентного иона при электролизе. Подставив же значение этого заряда в выражение для удельного заряда электрона, можно найти массу последнего. Эта масса оказывается меньше массы иона водорода примерно в 1800 раз. В настоящее время приняты следующие значения фундаментальных постоянных: заряд электрона равен 1,601 10 –19 Кл; масса электрона 9,08 10 –28 г, что меньше массы атома водорода примерно в 1840 раз.
В связи с исследованиями Томсоном свойств и природы катодных лучей хотелось бы также упомянуть о его вкладе в исследование природы фотоэффекта. В механизме этого явления в то время ясности не было – ни в работах А.Г.Столетова (умершего в мае 1896 г., т.е. до открытия электрона), ни в работах европейских физиков – итальянца А.Риги, немца В.Гальвакса, – а тем более в исследованиях Г.Герца, который умер ещё в 1894 г. Томсон в 1899 г., исследуя фотоэффект по экспериментальной методике, схожей с методикой исследования свойств катодных лучей, установил следующее. Если полагать, что электрический ток, возникающий при фотоэффекте, есть поток отрицательно заряженных частиц, то можно теоретически рассчитать движение частицы, образующей этот ток, одновременно действуя на неё электрическим и магнитным полями. Эксперименты Томсона подтвердили: ток между двумя противоположно заряженными пластинами при освещении катода ультрафиолетовыми лучами есть поток отрицательно заряженных частиц. Измерения заряда этих частиц, проведённые по той же методике, по которой ранее Томсон измерял заряд ионов, дали среднее значение заряда, по порядку величины близкое к значению заряда частиц, образующих катодные лучи. Отсюда Томсон заключил, что в обоих случаях следует говорить о частицах одной и той же природы, т.е. об электронах.
Атом Томсона. Проблема «увязки» открытых электронов со строением вещества была поставлена Томсоном уже в его работе по определению удельного заряда электронов. Первая модель атома, предложенная Томсоном, базировалась на опытах А.Майера (США) с плавающими магнитами, которые проводились ещё в конце 70-х гг. XIX в. Эти опыты заключались в следующем. В сосуде с водой плавали пробки, в которые были вставлены слегка выглядывавшие из них намагниченные иглы. Полярность видневшихся концов игл была на всех пробках одной и той же. Над этими пробками на высоте около 60 см располагался противоположным полюсом цилиндрический магнит, и иглы притягивались к магниту, одновременно отталкиваясь друг от друга. в итоге эти пробки самопроизвольно образовывали различные равновесные геометрические конфигурации. Если пробок было 3 или 4, то они располагались в вершинах правильного многоугольника. Если их было 6, то 5 пробок плавали в вершинах многоугольника, а шестая оказывалась в центре. Если же их было, к примеру, 29, то одна пробка опять-таки находилась в центре фигуры, а остальные располагались вокруг неё кольцами: в ближнем к центру кольце плавали 6, в следующих кольцах по мере удаления от центра соответственно 10 и 12. Эту механическую конструкцию Томсон перенёс на строение атома, видя в ней возможность объяснения закономерностей, заложенных в Периодической системе Д.И.Менделеева (имеется в виду послойное распределение электронов в атоме). Однако в данном случае оставался открытым вопрос о конкретном числе электронов в атоме. И если предположить, что электронов, например, несколько сотен (особенно с учётом того, что масса электрона ничтожна по сравнению с массой иона водорода), то изучение поведения электронов в такой конструкции практически невозможно. Поэтому уже в 1899 г. Томсон видоизменил свою модель, предположив, что нейтральный атом содержит большое число электронов, отрицательный заряд которых компенсируется «чем-то, что делает пространство, в котором рассеяны электроны, способным действовать так, как если бы оно имело положительный электрический заряд, равный сумме отрицательных зарядов электронов» .
Спустя несколько лет в журнале «Philosophical Magazine » (№ 2, 1902 г.) появилась работа другого Томсона – Уильяма, известного как лорд Кельвин, – в которой рассматривалось взаимодействие электрона с атомом. Кельвин утверждал, что внешний электрон притягивается к атому с силой, обратно пропорциональной квадрату расстояния от центра электрона до центра атома; электрон же, входящий в состав атома, притягивается к последнему с силой, прямо пропорциональной расстоянию от центра электрона до центра атома. Отсюда видно, в частности, что Кельвин рассматривает электроны не только как самостоятельные частицы, но и как составную часть атома. Этот вывод «равносилен допущению о равномерном распределении положительного электричества в пространстве, занимаемом атомом обычной материи. Из этого следовало, что существует два рода электричества: отрицательное, зерновидное, и положительное, в виде непрерывного облака, как обычно представляли себе „флюиды” и, в частности, эфир» . В целом можно сказать, что, по Кельвину, в атоме наличествуют равномерное сферическое распределение положительного электрического заряда и определённое количество электронов. Если речь идёт об одноэлектронном атоме, то электрон должен находиться в центре атома, будучи окружённым облаком положительного заряда. Если же в атоме находятся два или больше электронов, то встаёт вопрос об устойчивости такого атома. Кельвин высказал допущение, что, по-видимому, электроны вращаются вокруг центра атома, будучи расположенными на сферических поверхностях, концентричных границе атома, и эти поверхности также находятся внутри атома. Но в этом случае возникают проблемы: при движении заряженной частицы должно возникнуть магнитное поле, а при движении с ускорением (а вращающийся электрон неизбежно имеет центростремительное ускорение) должно иметь место электромагнитное излучение. Исследованием этих вопросов и занимался Томсон, оставаясь в течение примерно пятнадцати лет сторонником идей Кельвина.
Уже в 1903 г. Томсон установил, что вращающиеся электроны должны порождать эллиптически поляризованные световые волны. Что же касается магнитного поля вращающихся зарядов, то, как показывает теория, при вращении электронов под действием силы, пропорциональной расстоянию от заряда до центра вращения, объяснить магнитные свойства вещества можно лишь при условии рассеяния энергии. На вопрос о том, существует ли реально такое рассеяние, Томсон внятного ответа не дал (по-видимому, понимая, что наличие такого рассеяния породит проблему устойчивости конструкции атома).
В 1904 г. Томсон рассмотрел проблему механической устойчивости атомной структуры. Несмотря на то, что ныне такой подход воспринимается как анахронизм (поведение частиц, образующих атом, следует рассматривать с позиций не классической, а квантовой механики, о которой в те времена не было известно решительно ничего), на результатах, полученных Томсоном, всё же имеет смысл остановиться.
Во-первых, Томсон установил, что электроны в атоме должны быстро вращаться и скорость этого вращения не может быть меньше некоторой предельной. Во-вторых, если число электронов в атоме больше восьми, то электроны должны располагаться несколькими кольцами, и число электронов в каждом кольце должно расти с ростом радиуса кольца. В-третьих, для радиоактивных атомов скорость электронов вследствие радиоактивного излучения должна постепенно убывать, и на некотором пределе убывания должны происходить «взрывы», приводящие к образованию новой атомной структуры.
Ныне общепризнана появившаяся в 1910 г. планетарная модель Резерфорда, впоследствии усовершенствованная с квантовых позиций Н.Бором. Тем не менее модель Томсона ценна в плане постановки: 1) проблемы связи числа электронов и их распределения с массой атома; 2) проблемы природы и распределения в атоме положительного заряда, компенсирующего общий отрицательный электронный заряд; 3) проблемы распределения массы атома. Эти проблемы решались в процессе последующего развития физики ХХ в., и их решение в итоге привело к современным представлениям о строении атома.
Экспериментальное доказательство существования изотопов. Сама мысль о том, что атомы одного и того же химического элемента могут иметь разные атомные массы, возникла задолго до того, как Томсон начал заниматься «изотопной проблемой». Эту мысль в XIX в. высказывал основоположник органической химии А.М.Бутлеров (1882) и несколько позже У.Крукс (1886). Первые радиоактивные изотопы получил в 1906 г. американский химик и одновременно физик Б.Болтвуд (1870–1927) – два изотопа тория с разными периодами полураспада. Сам термин «изотоп» несколько позже ввёл Ф.Содди (1877–1956) после того, как им были сформулированы правила смещения для радиоактивного распада. Что же касается Томсона, то он в 1912 г. экспериментально изучал свойства и особенности так называемых каналовых лучей , и о том, что это такое, следует сказать несколько слов.
Речь идёт о потоке положительных ионов, движущихся в разреженном газе под действием электрического поля. При соударении электронов с газовыми молекулами у катода в области тлеющего разряда и катодного падения потенциала молекулы расщепляются на электроны и положительные ионы. Эти ионы, разгоняясь электрическим полем, приходят к катоду с большой скоростью. Если в катоде имеются отверстия по направлению движения ионов, либо если сам катод имеет форму сетки, то часть ионов, пройдя по этим каналам, окажется в закатодном пространстве. Изучением поведения таких ионов начал заниматься ещё в 80-е гг. XIX в. ранее упоминавшийся Э.Гольдштейн. Томсон же в 1912 г. изучал воздействие на каналовые лучи (конкретно для ионов неона) одновременно электрического и магнитного полей по той методике, о которой уже говорилось (имеется в виду томсоновский «метод парабол»). Пучок ионов неона в его опытах разделялся на два параболических потока: яркий, соответствовавший атомной массе 20 и более слабый, соответствовавший атомной массе 22. Из этого Томсон сделал вывод о том, что содержащийся в атмосфере Земли неон является смесью двух разных газов. Ф.Содди оценил результаты исследований Томсона следующим образом: «Это открытие представляет собой самое неожиданное приложение того, что было найдено для одного конца Периодической системы, к элементу другого конца системы; оно подтверждает предположение о том, что структура материи вообще существенно сложнее, чем это проявляется в одном лишь периодическом законе» . Результат имел огромное значение не только для атомной физики, но и для последующего развития физики экспериментальной, ибо указывал способы измерения масс различных изотопов.
В 1919 г. ученик и ассистент Томсона Фрэнсис Уильям Астон (1877–1945) построил первый масс-спектрограф, с помощью которого опытным путём доказал наличие изотопов у хлора и ртути. В масс-спектрографе применяется именно томсоновский метод отклонения заряженных частиц под действием двух полей, электрического и магнитного, однако в приборе Астона применялось фотографирование разделённых потоков ионов с разными атомными массами, а кроме того, использовалось отклонение заряженной частицы в электрическом и магнитном полях – в одной и той же плоскости, но в противоположных направлениях. Физика же работы масс-спектрографа в главном состоит в следующем. «Ионы исследуемого вещества, проходя вначале электрическое, а затем магнитное поле, попадают на фотопластинку и оставляют на ней след. Отклонение ионов зависит от отношения e /m , одинакового для всех ионов (или, лучше сказать, от ne /m , потому что ион может нести более одного элементарного заряда). Поэтому все ионы одинаковой массы концентрируются в одной и той же точке фотопластинки, а ионы другой массы – в других точках, так что по точке попадания иона на пластинку можно определить его массу» .
В заключение – несколько слов о созданной Томсоном научной школе. Его учениками являются такие крупнейшие физики ХХ в., как П.Ланжевен, Э.Резерфорд, Ф.Астон, Ч.Вильсон. Трое последних в разные годы, как и сам Томсон, были отмечены Нобелевскими премиями по физике. Особо отметим его сына. Отец-Томсон экспериментально доказал сам факт существования электрона, а сын, Джордж Паджет Томсон был удостоен в 1937 г. Нобелевской премии за экспериментальное доказательство волновой природы электронов (1927; в том же году независимо от Томсона-младшего аналогичные исследования провёл К.Дэвиссон совместно со своим сотрудником Л.Джермером. Оба были физиками из США; Дэвиссон был также удостоен Нобелевской премии). Вот как оценивал эти исследования в 1928 г. Эрвин Шрёдингер: «Некоторые исследователи (Дэвиссон и Джермер и молодой Дж.П.Томсон) приступили к выполнению опыта, за который ещё несколько лет назад их бы поместили в психиатрическую больницу для наблюдения за их душевным состоянием. Но они добились полного успеха» .
После 1912 г., отмеченного экспериментальным доказательством существования изотопов, Томсон прожил ещё двадцать восемь лет. В 1918 г. он покинул пост директора Кавендишевской лаборатории (его место занял Резерфорд) и далее до конца своих дней возглавлял тот самый Тринити-колледж, откуда начинался когда-то его путь в науку. Умер Джозеф Джон Томсон на 84-м году жизни 30 августа 1940 г. и был похоронен в Вест-минстерском аббатстве – там же, где обрели вечный покой Исаак Ньютон, Эрнест Резерфорд, а из деятелей английской литературы – Чарльз Диккенс.
Литература
1. Жизнь науки. Под ред. Капицы С.П. – М.: Наука, 1973.
2. Капица П.Л. Эксперимент. Теория. Практика. – М.: Наука, 1981.
3. Дорфман Я.Г. Всемирная история физики с начала XIX до середины XX вв. – М.: Наука, 1979.
4. Льоцци М. История физики. – М.: Мир, 1970.